Los conocimientos químicos están muy presentes en nuestra vida cotidiana, aunque algunas personas los tachen de antinatural, o consideren que no son necesarios. Existen numerosos ejemplos que demuestran que la química es imprescindible en nuestras vidas, es por ello que desde tiempos remotos nuestros antepasados hacían uso de ella sin conocer el fundamento de esas aplicaciones.
Si nos centramos en las necesidades básicas de todo ser humano, diríamos que la higiene y limpieza es una de las más importantes. Para llevar a cabo esta tarea, se elaboran productos coloquialmente conocidos como jabones, de los cuales el más elaborado artesanalmente es el jabón de sosa usando como reactivos aceite usado, sosa y agua. Para ello, se seguían recetas que pasaban de generación en generación.
Actualmente todo el mundo conoce la elaboración y utilidades de este producto, pero ¿saben que lleva un fundamento químico a sus espaldas?, ¿conocen las razones por las cuales mezclamos esos reactivos y no otros distintos?, y lo más importante, ¿están al tanto de por qué y cómo realiza su función de limpieza tan efectiva?.
Todas estas cuestiones serán detalladas en los siguientes apartados en los que daremos explicaciones químicas al método de elaboración de este jabón.
- FUNDAMENTO TEÓRICO
La elaboración del jabón de sosa se trata simplemente de una reacción de saponificación en medio básico, que consiste en la hidrólisis de un éster, es decir, la rotura de los enlaces de la molécula de éster causada por moléculas de agua. Esta reacción se da entre un ácido graso o lípido saponificable y una base disuelta en medio acuoso [1]. Es por esto que los reactivos artesanales usados son:
-Aceite usado como fuente de lípidos saponificables.
-Sosa (hidróxido sódico, NaOH) para alcalinizar el medio de reacción (aspecto clave).
-Agua, responsable de la hidrólisis.
Como lípido saponificable consideramos una molécula (éster) que esté formada por la unión de un alcohol y uno o varios ácidos grasos. Los más importantes son los triacilglicéridos, ésteres presentes en el aceite formados de glicerina (molécula que aporta tres grupo alcoholes) y 3 cadenas de ácidos grasos [1]
 |
| [2] Figura 1: Estructura de triacilglicéridos y sus constituyentes (ácidos grasos y glicerina) |
Reacción de saponificación: se lleva a cabo mezclando los reactivos anteriormente mencionados, siguiendo un cierto orden. Como productos obtenemos las sales sódicas de los ácidos grasos presentes en el aceite (son las que conocemos como jabón) y glicerina (aporta el aspecto pastoso).
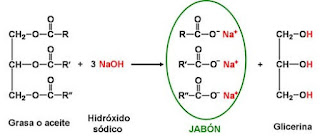 |
| [3] Figura 2: reacción de saponificación Obtención del jabón de sosa |
- SÍNTESIS POR PASOS:
Vamos a tratar la síntesis del jabón de sosa paso por paso desde un punto de vista práctico, a la vez que la comparamos con los aspectos teóricos de la reacción.
1-Preparamos una disolución de sosa, mezclando NaOH y agua bajo agitación. La mezcla desprende calor (se trata de una reacción exotérmica) y por ello se calentará el recipiente.
Vídeo 2: Agitación para el mezclado
La disolución de la sosa en agua hace que se generen cationes sodio (con carga positiva) y aniones hidroxilo (con carga negativa). Por otra parte, el agua aporta aniones hidroxilo y protones [8]
2-Añadimos el aceite usado a nuestra disolución acuosa de sosa a la vez que agitamos continuamente.
Una vez que se ponen en contacto los reactivos, comienza a darse la reacción se saponificación.
Los aniones hidroxilo se enlazan al carbono carboxílico, provocando la rotura del enlace simple carbono-oxígeno. Después, los cationes sodio se unen al oxígeno que está unido al carbono carboxílico (es el que soporta el doble enlace carbono-oxígeno) y los protones hacen que se forme la glicerina o glicerol [8]. Todo esto se detalla en la Figura 3.
 |
| Figura 3: mecanismo de reacción |
Así obtenemos dos productos integrados en un sólido pastoso como se muestra en la imagen 1:
-Ésteres sódicos, que son los llamados jabones y van a desempeñar la acción de limpieza.
-Glicerina como producto secundario. No se elimina debido a que facilita el manejo del jabón.
 |
| Imagen 1: Jabón de sosa |
- ACCIÓN DE LIMPIEZA:
La acción de limpieza del jabón se debe a su habilidad de mantener en suspensión compuestos que normalmente no se disuelven en agua pura, una forma de eliminar la suciedad (materia orgánica) adherida. Esto se debe a que la molécula de jabón es anfipática, es decir, su estructura tiene una parte con afinidad al agua (parte polar) y otra con afinidad a la materia orgánica (parte apolar) [1].
 |
| [4] Imagen 2: estructura anfipática del jabón |
Las partes polares y apolares se repelen. Para disminuir esta repulsión, las partes apolares se unen formando una estructura llamada micela. Como estas partes estaban unidas a la materia orgánica, esta también queda dentro de la micela. De esta forma, conseguimos eliminar la suciedad porque las micelas quedan dispersadas en el medio acuoso durante el enjuague [1].
 |
| [5] Imagen 3: Estructura micelar con grasa adherida Dispersión en medio acuoso. |
- ALTERNATIVA: JABÓN SIN SOSA:
Últimamente tendemos a querer fabricar nuestros propios productos de higiene personal, como el jabón para la piel y para el pelo. El jabón más famoso es el de sosa, pero éste perjudica nuestra piel y al entorno. Por ello, se han buscado recetas alternativas sin este ingrediente dañino.
Un buen sustituto para la sosa cáustica es la saponaria, la cual es una planta conocida. Sus propiedades son similares a la del jabón, pues contiene saponinas, que son glucósidos de esteroides y son solubles tanto en lípidos como en agua, haciendo espuma como el jabón convencional e igualando su poder de limpieza [7].
 |
| [6] Imagen 4: saponaria |
Para fabricar este jabón, hay que extraer los componentes de la planta mediante infusiones en agua hirviendo, durante unos 15 minutos, y luego mezclarlo con el resto de reactivos, a los cuales hay que añadir glicerina. Esto es debido a que no se da la reacción de saponificación y no aparece este producto [7].
- REFERENCIAS :
-[1]https://imaritimo.cl/wp-content/uploads/2020/09/SAPONIFICACION.pdf (acceso noviembre 2021)
-[2] Figura 1: https://medicoquieroser.blogspot.com/2018/05/lipidos-2-lipidos-saponificables.html (acceso noviembre 2021)
-[3] Figura 2: https://zonajabones.com/saponificacion/ (acceso noviembre 2021)
-[4] Imagen 2:https://neetescuela.org/quimica-en-accion-como-actua-el-jabon/ (acceso noviembre 2021)
-[5] Imagen 3:http://dimetilsulfuro.es/2012/09/25/por-que-limpia-el-jabon/ (acceso noviembre 2021)
-[6] Imagen 4: https://es.wikipedia.org/wiki/Saponaria (acceso noviembre 2021)
-[7]https://www.ecologiaverde.com/como-hacer-jabon-casero-sin-sosa-caustica-1049.html (acceso noviembre 2021)
-[8] https://www.quimicaorganica.org/esteres/449-hidrolisis-basica-de-esteres-saponificacion.html (acceso noviembre 2021)
No hay comentarios:
Publicar un comentario